Mi a különbség a telítetlen, telített gőz, mi a különbség
Mielőtt válaszol a feltett kérdésre a cím, meg fogjuk érteni, hogy ez a pár. Képek, ami a legtöbb ember ezt a szót: vízforraló, vagy fazék, gőzfürdő, forró italt, és még sok ilyen kép. Különben is, mi ötleteket jelen folyékony és gáznemű anyag, amely fölé emelkedik a felszínre. Ha arra kérik, hogy egy példa egy pár, akkor azonnal gondol vízgőz, alkohol gőzök, éter, benzol, aceton.

Van egy másik szó a gáz halmazállapotú - gáz. Itt felidézzük rendszerint oxigén, hidrogén, nitrogén és más gázok, anélkül, hogy bevonják őket a megfelelő folyadékot. Ebben az esetben a jól ismert, hogy ezek léteznek, folyékony állapotban. Első pillantásra, a különbségek abban rejlik, hogy a pár megfelel a természetes folyadékokat, és szükség van felenged gázok specifikusan. Ez azonban nem teljesen igaz. Ráadásul a képek eredő szó pár - a komp nem. Annak érdekében, hogy pontosabb választ, nézzük, hogyan párok vannak.
A különböző pár a gáz?
Fizikai állapot anyag adott hőmérsékleten, pontosabban közötti kapcsolat az energia, amellyel a kölcsönhatásba a molekula energiája a véletlenszerű hőmozgás. Körülbelül, akkor feltételezhetjük, hogy ha a kölcsönhatási energia sokkal - szilárd állapotban, ha lényegesen több energiát hőmozgást - gáz-halmazállapotú, ha hasonló energia - folyadék.
Kiderült, hogy a molekula jöhet le a folyadékot, és részt vesz a kialakulását a gőz és a hőenergia nagyobbnak kell lennie, mint a kölcsönhatás energia. Hogyan történhet ez meg? Az átlagos sebesség a termikus mozgás molekulák egyenlő egy bizonyos értéket a hőmérséklettől függően. Ugyanakkor az egyes molekulák különböző sebességgel: többségük sebesség közel az átlag, de egy része nagyobb, mint az átlagos, egy bizonyos - kevésbé.
Minél gyorsabb a molekulák egy hőenergia nagyobb, mint a kölcsönhatás energiája, ami azt jelenti, hogy üti a felület egy folyadék, képesek tegye le, alkotó párokat. Egy ilyen eljárás az úgynevezett párologtatás párolgás. Miatt ugyanazt a sebességeloszlás létezik, és az ellentétes folyamat - kondenzációs: molekulák a gőz folyadékká. Mellesleg képek jellemzően fordul elő, ha a szó gőz nem gőz, ennek eredményeként az ellenkező folyamat - kondenzáció. Párok nem lehet látni.

Gőz bizonyos feltételek mellett lehet folyékony, de a hőmérséklet nem haladhatja meg egy bizonyos értéket. Ezt az értéket nevezzük a kritikus hőmérséklet. A gőz és a gáz - a gáz halmazállapotú, azzal jellemezve, a hőmérsékletet, amelyen azok léteznek. Ha a hőmérséklet nem haladja meg a kritikus - párokat, ha túllépi - gáz. Ha tartod a hőmérsékletet állandó és mennyiségének csökkentése gőz - cseppfolyósított gáz - nem cseppfolyósított.
Mi a gőz telített és telítetlen
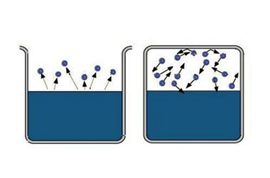
A „gazdag” van néhány információ, nehéz telíteni nagy régió helyet. Tehát, hogy a telített gőz, szükséges, hogy korlátozza a tér, amelyben a folyadék. A hőmérséklet ezért kevésbé kritikus egy adott anyag. Most elpárologtatott molekulák maradnak a területen, ahol a folyadék van. Először, a legtöbb molekulák átmenetek fog bekövetkezni a folyékony, a gőz sűrűség növekszik. Ez viszont okoz nagyobb számú inverz átmenetek molekulák a folyadékban, amely növeli a kondenzáció sebességét.
Végül, egy állapot létesül, hogy az átlagos száma molekulák halad az egyik fázisból a másikba egyenlő lesz. Ez az úgynevezett dinamikus egyensúly. Ezt az állapotot az jellemzi, egyenlő változás nagyságát és irányát a párolgás és kondenzáció arányok. Ez az állapot megfelel a telített gőzt. Ha a dinamikus egyensúly állapotában eléri, ez megfelel egy telítetlen gőz.
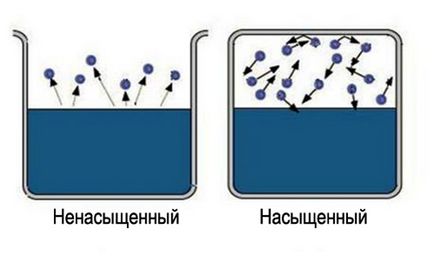
Kezdeni tanulni néhány tárgyat, mindig a legegyszerűbb modellje. A molekuláris kinetikai elmélet ez - az ideális gáz. A fő az egyszerűsítés - elhanyagoljuk saját hangerő molekulák és azok kölcsönhatása energiákat. Kiderült, hogy ez a modell kielégítően leírja telítetlen gőz. Sőt, annál kevésbé telített, a jogszerűségét annak alkalmazását. Az ideális gáz - a gáz, akkor nem válhat sem gőz vagy folyadék. Ezért telített gőz, ez a modell nem megfelelő.
A fő különbség a telítetlen gőz
- Telített azt jelenti, hogy az objektum a legnagyobb érték az egyes paramétereket. Steam - ez sűrűség és a nyomás. Ezek a paraméterek a telítetlen gőz kisebb értékeket. A távolabb a telített gőz, az alacsonyabb érték. Egy pontosítás: összehasonlítva a hőmérséklet állandó legyen.
- Mert telítetlen gőz végezzük Boyle-törvény. ha a hőmérséklet és a masszát a gáz állandó, növelni vagy térfogatának csökkenését csökkenését okozza, vagy nyomásnövekedés ugyanazzal a tényezővel, nyomás, és a térfogat - kapcsolódó fordítottan arányos. Mivel a maximális sűrűség és a nyomás állandó hőmérsékleten arra utal, hogy ezek független a mennyisége gőz, úgy tűnik, hogy a telített gőz nyomás és térfogat - függetlenek egymástól.
- A telítetlen gőz sűrűség nem függ a hőmérséklettől. és ha a mennyiség van tárolva, akkor nem változik a sűrűsége. Telített gőz, miközben a térfogatsűrűség változik, amikor a hőmérséklet-változás. A függőség ebben az esetben a vonalon. Ha a hőmérséklet növekedésével a sűrűség növekedésével és ha a hőmérséklet csökken, a sűrűség is változik.
- Ha a térfogat állandó, telítetlen gőz viselkedik a törvény szerint a Charles: a hőmérséklet emelkedésekor ugyanazzal a tényezővel megnő, a nyomás. Ez a függőség az úgynevezett lineáris. Egy telített gőz nyomása a hőmérséklet növekedésével gyorsabban növekszik, mint a telítetlen gőz. A függőség exponenciális.
Összefoglalva, nem volt szignifikáns különbség a tulajdonságok a tárgyakat képest. A fő különbség az, hogy a párok állapotban telítettség, nem lehet elválasztani a folyékony. Ez két összetevőből álló rendszer, amelyben lehetetlen használni a gáz többsége törvényeket.