Írja egyenletek kémiai reakciók
A atomok száma külön reagensként anyagok és anyagok összetétele a reakciótermékek, segítségével határozzuk meg a periódusos rendszer a kémiai elemek DI Mengyelejev
Milyen meglepő, hogy a természet az ember: ez körülöleli a föld a téli hó paplan, tavaszi - megnyitja mint pehely pattogatott kukorica, minden élő a nyáron - a dühöngő lázadás a színek, őszi meggyullad vörös növényi tüzet. Csak akkor, ha belegondolunk, és megnézed, akkor láthatod, hogy vannak ezek a változások olyan ismerős bonyolult fizikai folyamatok és a kémiai reakciókat. És annak érdekében, hogy vizsgálja meg minden élet, akkor képesnek kell lennie arra, hogy megoldja a kémiai egyenletek. A fő követelmény a kiigazítás kémiai egyenletek - jogi ismeretek megőrzése anyag: 1) az az összeg az anyag a reakció megegyezik az anyag mennyiségét a reakció után; 2) a teljes összeg az anyag a reakció előtti egyenlő a teljes anyag mennyiségét a reakció után.
Hogy kiegyenlítse a kémiai „példa” Több lépésekre van szükség.
Feljegyezzük a reakció egyenletet általános formában. Ebből a célból az ismeretlen együtthatókat a képletek jelölik anyagok latin ábécé (x, y, z, t, stb). Legyen ez szükséges, hogy kiegyenlítse a reakciót hidrogén és oxigén vegyületek, ami azt eredményezi, vízben. Mielőtt a molekulák hidrogén, oxigén, és vízellátás betűk (x, y, z) - együtthatók.
Az egyes cikkek alapján az anyagmérleg, hogy egy matematikai egyenlet és egyenletrendszer. Ebben a példában a hidrogén a bal oldalon, hogy a 2, hiszen az index „2” a jobb oldalon - 2z, hiszen ő is egy kódot „2”. kapott 2x = 2z, így, X = z. Oxigén balra, hogy 2y, hiszen van egy index „2” a jobb oldalon - z, mert az index nem, akkor ő az egyik, ami általában nem írok. Kiderült, 2y = z, és z = 0,5y.
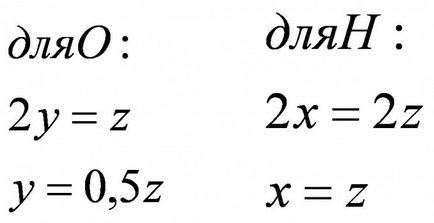
Count száma (az anyagok száma), és az ismeretlenek száma (az elemek száma). A kiválasztott példában: fordult rendszer két egyenlet: X = z, és y = 0,5z.
Ha az egyenlet magában nagyszámú kémiai elemek, a feladat nem bonyolult, és térfogata megnő, akkor nem kell félni.
Lehetőség van, hogy kiegyenlítse a választ, és használja az elmélet a valószínűség, a kémiai vegyértékű elemek.
- Kémia :. Minden a tanár. Kiadó „Basis”, a tapasztalat a tanár fizika.
Redox reakciók - a reakció, hogy a változás a oxidáció mértéke. Gyakran előfordul, hogy adott a kiindulási anyagok és kell írni reakció termékei. Néha az azonos anyagot adni a különböző végtermékek különböző környezetekben.

Attól függően, nem csak a reakcióközegben, és az oxidáció mértékét az anyag másképp viselkedik. Anyag a legmagasabb oxidációs állapotban mindig egy oxidálószer alacsonyabb - redukáljuk. Ahhoz, hogy a savas közegben, általában használt kénsav (H2SO4), legalább - salétromsav (HNO3) és sósav (HCI). Ha szükséges alkalmazni létre lúgos környezetben nátrium-hidroxiddal (NaOH) és kálium-hidroxid (KOH). Következő, nézd meg néhány példát az anyagok.
Ion MnO4 (-1). A savas közegben átalakítjuk Mn (+2), színtelen oldat. Ha a közeg semleges, majd képződött MnO2, barna színű csapadékot kiesik. Lúgos környezetben kapjuk MnO4 (+2), zöld színű oldat.
A hidrogén-peroxid (H2O2). Ha ez egy oxidálószer, azaz elektronokat, semleges és lúgos közegben átalakítjuk séma szerint: H2O2 + 2e = 2OH (-1). A savas közegben kapjuk: H2O2 + 2H (+1) + 2e = 2H2O.
Feltéve, hogy a hidrogén-peroxid redukáiószer, hogy veszít elektronokat, képződik savas közegben O2, lúgos - O2 + H2O. Ha a H2O2 a környezetbe kerül egy erős oxidálószer, ő lesz csökkentve.
Cr2O7 ion egy oxidálószerrel, savas közegben az átalakul 2CR (+3), amelynek van egy zöld színű. A ion Cr (+3) jelenlétében hidroxidion, azaz lúgos környezetben képződik CrO4 (-2) sárga.
Itt egy példa a kidolgozása a reakciót.
KI + KMnO4 + H2SO4 -
Ebben a reakcióban, Mn érték a legmagasabb oxidációs állapotban, azaz, egy oxidálószer, elfogadó elektronok. Savas, megmutatja, hogy kénsav (H2SO4) .Vosstanovitelem itt I (-1), akkor veszít elektronokat, miközben növeli az oxidáció mértéke. Írja reakciótermékek: KI + KMnO4 + H2SO4 - MnSO4 + I2 + K2SO4 + H2O. Mi megszervezzük az együtthatók elektronikus mérleg módszer vagy fél reakció, megkapjuk: 10KI + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O.
Ne felejtsük el, hogy helyezze a koefficiensek a reakciókat!
Kémiai reakciók - az anyagok közti kölcsönhatás, kíséri változást a készítményben. Más szóval, olyan anyagok, amelyek reagálnak. nem felel meg a által termelt anyagokat a reakció. Ilyen kölcsönhatások személy szembesül óránként, percenként. Miután az összes folyamatot a testében (légzés, fehérjék szintézisét, emésztés, stb) - is egy kémiai reakció.

Bármely kémiai reakció kell írni helyesen. Az egyik alapvető követelmények -, hogy a atomok száma minden egyes eleme anyagok, amelyek a bal oldalon a reakció (a továbbiakban „kiindulási anyag”), megfelel az atomok száma az azonos elem jobb oldalán anyagok (a továbbiakban: - „reakció termékek”). Más szóval, a reakció legyen utáni egyenletek.
Vegyünk egy konkrét példát. Mi történik, ha a konyhában fény a gázégő? Természetes gázt reagáltatunk légköri oxigénnel. Az oxidációs reakciót úgy exoterm, hogy kíséri megjelenése hő, gyújtás bekövetkezik. Segítségével amit vagy étel vagy újra felmelegít már főzött.
Egyszerűsítése elismerik, hogy a földgáz az csak az egyik alkotóeleme - metán, amelynek a képlete CH4. Tehát hogyan lehet létrehozni és egyenlővé ezt a reakciót?
Égése során egy széntartalmú tüzelőanyag, azaz az oxidációs szén oxigénnel széndioxidot termel. Tudja a képlet: CO2. És mi van kialakítva az oxidációs metán tartalmazott oxigén-hidrogén? Természetesen, a vizet gőz formájában. Ó, hogy egy formula tudja fejből még a legtávolabb a kémia az emberek: H2O.
Így írja le a bal oldalon a reakció kiindulási anyagok: CH4 + O2.
A jobb oldalon, rendre, amelyek a reakció termékei: CO2 + H2O.