Közös előállítási módszereinek fémek
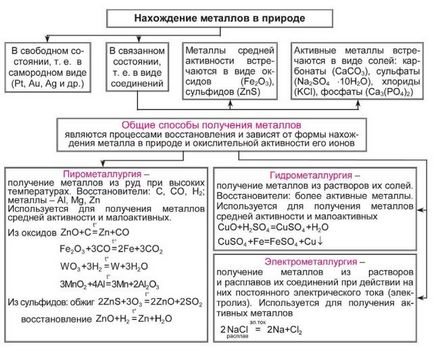
Sok fém kémiai aktivitást (reakció légköri oxigén és más nem-fémek, víz, só-oldatok, savak) vezet az a tény, hogy a földkéreg találhatók elsősorban vegyületek formájában: oxidok, szulfidok, szulfátok, kloridok, karbonátok, stb ... szabad állapotban vannak fémek az elektrokémiai sorban elrendezve, hogy a megfelelő hidrogén (Ag, Hg, Pt, Au, Cu), bár gyakrabban réz és a higany megtalálható a természetben formájában vegyületek.
Az ásványok és fekete kőzetek tartalmazó fémek és vegyületek, amelyekből az izolálását tiszta fémek technikailag lehetséges és gazdaságilag megvalósítható, az úgynevezett ércek.
Fémek előállítása ércből - feladat kohászat.
Kohó - ez a tudomány az ipari folyamatok a fémek előállítása ércből, és az ipari szektorban.
Bármely fémkohászati folyamatban - egy folyamat csökkentése fémionok segítségével különböző redukálószerek. lehetőség van arra, hogy kifejezze a lényege a következő:
Ezen eljárás végrehajtásához szükséges, hogy vegye figyelembe a tevékenység a fém, kiválaszthassa a redukálószer, hogy vizsgálják meg a technológiai, gazdasági és környezeti tényezők.

Ennek megfelelően, ott vannak a következő módszerek előállítására fémek:
pyrometallurgy
Pyrometallurgy - hasznosítás fémek ércekből magas hőmérsékleten szén, a szén-monoxid (II), a hidrogén, fémek - alumínium és magnézium.
Például, ón felépült a Kassziterit SnO2. és réz - a kuprit CU2O
kalcinálásából szén (koksz)
SnO2 + 2C = Sn + 2CO ↑; Cu2 O + C = 2Cu + CO ↑
Szulfid érc előzetesen kalcináltunk levegőn, majd a kapott szén-monoxid csökken:
2ZnS + 302 = 2ZnO + 2SO2 ↑; ZnO + C = Zn + CO ↑
sphalerite (cink cinkféle)
A visszanyert fém-karbonát ércek is kalcinálásával szén, hogy az, hogy bomlanak karbonátok melegítés során, egyre-oxidok, és az utóbbi visszanyert szén ..:
FeSO3 = FeO + CO 2 ↑; FeO + C = Fe + CO ↑
sziderit (sziderit)
A szén lehet beszerezni Fe, Cu, Zn, Cd, Ge, Sn, Pb és más fémek, amelyek nem képezik az erős karbidok (vegyületek a szén).
Redukálószerként alkalmazható aktív hidrogénatom vagy fémek:
A módszer előnyei közé tartozik a termelés nagyon tiszta fém.
2) TiO2 + 2 Mg = Ti + 2MgO (magniytermiya)
ZMnO2 + 4Al = ZMn + 2Al2 O3 (aluminothermy)
Leggyakrabban használt metallothermy alumínium-oxid képződéshő
ami nagyon magas (2A1 + 1,5 O2 = Al2 O3 + 1676 kJ / mól). Elektrokémiai feszültségek száma fémek nem használható annak meghatározására, hogy az áramlás redukciós reakciók a fém-oxidok. Körülbelül megteremti a lehetőséget ennek a folyamatnak lehet alapul a számítás a termikus hatás a reakció (Q), tudván, az értéke a képződéshő oxidok:
ahol Q1 - képződéshő a termék, Q2 -teplota kialakulását kiindulási anyag.
Nagyolvasztó (nyersvas termelés):
C + O2 = CO2. CO2 + C ↔ 2CO
3Fe2 O3 + CO = 2 (Fe 2 Fe 2 március) O4 + CO2
(Fe 2 Fe 2 március) O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
(Iron tartalmaz legfeljebb 6,67% szenet grafit formájában és cementitet szemes Fe3 C);
hidrometallurgiából
Hidrometallurgiai - csökkentését fémek sóikból oldatban.
A folyamat zajlik két szakaszból áll: 1) a természetes vegyületet feloldjuk egy megfelelő reagenssel, így a fémsó-oldat; 2) a kapott oldatot aktív fém lét préselt vagy több aktív csökken elektrolízissel. Például, így a réz ércből tartalmazó réz-oxid CuO, hogy kezeljük híg kénsavval:
Ezután, a réz vagy eltávolítottuk az oldatból elektrolízisével sója vagy kiszorulnak vas-szulfát:
Így, egy ezüst, cink, molibdén, arany, urán.
Elektrometallurgie
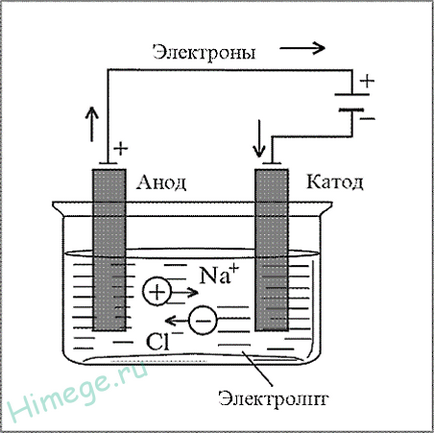
Elektrometallurgie - helyreállítási fémek előállítása elektrolízissel olvadékok vagy oldatok a vegyületeik.
Ez a módszer biztosítja az alumínium, alkálifémek, alkáliföldfémek. Amikor ez olvadék elektrolizáljuk oxidok, hidroxidok vagy kloridok.
példák: