Fémes és nem-fémes tulajdonságok a kémiai elemek
a) törvények kapcsolódó fémes és nem fémes elemek tulajdonságai.
1. Amikor a mozgó jobbról balra mentén időszakban fémes elemtulajdonságok fokozott. Az ellenkező irányban növeli a nemfémes.
Balról jobbra egy olyan időszakban is növekedett, és a díjat a sejtmagban. Ezért egyre nagyobb a vonzereje, hogy a mag és vegyérték elektronok akadályozzák azok visszarúgás.
2. Amikor mozog a TOP-DOWN csoportok merevítő fémelemeket tulajdonságait. Ez annak a ténynek köszönhető, hogy az alábbiakban a Csoport olyan elemek, amelyek már elég sokat töltött elektronhéjak. A külső héj távolabb a sejtmagban.
b) törvények kapcsolatos redox tulajdonságait. Változások elektronegativitási elemekkel.
1. BAL JOBB erősíteni oxidáló tulajdonságai, és a lefelé irányuló mozgást - redukáló tulajdonsága elemek.
2. Elektronegativitás is növeli balról jobbra. tetőzik halogének.
3. Ha mozgatja a tetejétől az aljáig csoport elektronegativitási csökken. Ez annak köszönhető, hogy egyre több az elektron pályák, amelyek közül az utolsó az elektronok vonzódnak a nucleus összes gyengül.
c) törvények méreteire vonatkozóan az atomok.
1. Méretek az atomok (atomrádiusz) mozgatásakor balról jobbra mentén időszakban csökken.
2. Amikor az TOP-DOWN atomrádiusz elemek nő. mert tele van több elektronikus kagyló.
Anyag szerkezete. Hibridizáció. A típusú kémiai kötéseket. Az ionizációs potenciál és elektronegativitás.
Minden test áll egyedi részecskék - molekulák és atomok. Molekulák - a legkisebb anyagi részecskék. A molekulák állnak atomok.
Alapvető információk az anyag összetétele:
1) Minden test áll egyedi részecskék (atomok és molekulák), amelyek között vannak hiányosságok.
2) A molekulák mozognak folyamatosan és kaotikusan.
3) A molekulák kölcsönhatásba lépnek (vonzzák és taszítják).
1) a molekulák ugyanazon anyagok azonosak.
2) A fűtés, a rések között a molekulák növekszik, és hűtés közben - csökkenés.
3) Mivel a hőmérséklet növekszik, a molekulák sebessége növekszik.
A szerkezeti típus valamennyi anyag vannak osztva a molekuláris és a nem-molekuláris. Azok közül a szerves anyagok érvényesülnek molekuláris anyagok közé tartoznak a szervetlen - nonmolecular.
Szerint a típusú kémiai kötőanyagok vannak osztva kovalens kötések az anyaggal, az anyag ionos kötések (ionos anyagok) és anyagok, fémes kötést (fémek).
Anyagok a kovalens kötés lehet molekuláris és a nem-molekuláris. Ez jelentős mértékben befolyásolja a fizikai tulajdonságai.
Molekuláris anyagok molekulákból áll kapcsolódik össze gyenge intermolekuláris kötések, ezek a következők: H2. O2. N2. Cl2. Br 2. S8. P4 és más egyszerű anyagok; CO2. SO2. N2 O5. H2 O, HCI, HF, NH3. CH4. C2 H5 OH, szerves polimerek, és sok más anyaggal. Ezek az anyagok nem rendelkeznek nagy szilárdságú, alacsony olvadás- és forráspontja, nem vezeti az áramot, amelyek közül néhány vízben oldható vagy más oldószerben.
Nonmolecular anyag kovalens kötésben vagy atomi anyag (. Diamond, grafit, Si, SiO2 SiC, stb) egy nagyon erős kristályok (kivéve - réteges grafit), ezek vízben oldhatatlan, és más oldószerek magas olvadáspontú és forráspontja, legtöbbjük nem áramvezetésre (kivéve grafit, amelynek vezetőképessége, és a félvezetők - szilícium, germánium, stb).
Az összes ionos anyagok természetesen nem-molekuláris. Ez a szilárd tűzálló anyagok, megoldások és megolvad, amelyek vezetik az elektromos áramot. Sokan közülük oldódik vízben.
Hibridizáció - változás az alakja néhány pályák a kovalens kötés, hogy jobban átfedés pályák.
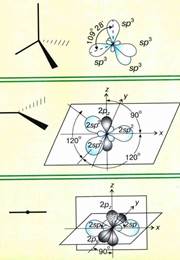
SP 2 - hibridizáció. Egy orbitális S- és p- pályák két átalakul három azonos „hibrid” pályák, a bezárt szög a tengelyek egyenlő 120 °.
Molekulák, amelyekben az SP 2 - hibridizáció, van egy planáris geometriát.
SP hibridizáció. Egy orbitális S- és P egy orbitális átalakítható két azonos „hibrid” pályák, a bezárt szög a tengelyek egyenlő 180 °. Molekulák, amelyekben az SP-hibridizáció, lineáris geometria.
A típusú kémiai kötéseket.
1) ion (fém + nemfémes)
2) Kovalens (+ nemfémes nemfémes keresztül megosztott elektronpár)
Típusai: * poláros (különböző nem-fémek)
* Nem-poláros (ugyanazt a nem-fémek)
Típusok: * létrehozta a csere mechanizmusa
* Alapítva donor-akceptor mechanizmus
Csere mechanizmusa - a kialakulása egy kötés magában foglal egy-elektron atomi pályák, azaz Minden egyes atom egy közös használatát egyetlen elektron:
Donor-akceptor mechanizmust (koordinációs kötés) - a kémiai két atom közötti kötést vagy atomcsoport, végzett miatt nem megosztott elektronpárt az egyik atom (donor), és egy szabad orbitális másik atom (akceptor).
3) Fém (közötti fématomok között a fém ionok és szabad elektronok megosztott)
4) Hidrogén (hidrogén közötti egy molekula és egy másik nagyobb elektronegativitású elem (O, S, N, F), és egy másik molekulával)
A ionizációs potenciálja az atom - a minimális potenciális különbség U., hogy át kell mennie egy elektron gyorsuló elektromos mező megszerzése érdekében elegendő mozgási energiával, hogy ionizálja atomok.
Elektronegativitás (EO) - relatív képességét, hogy vonzza az elektronokat az atomok kötődésének más atomokkal. Elektronegativitás jellemzi azt, hogy egy atom a a polarizáció a kémiai kötések.