Kémiai tulajdonságait alkánok
Alkánok kémiailag viszonylag inert anyagok,. Ezek nem lépnek kölcsönhatásba a reagensekkel, hogy könnyen reagálnak alkének vagy alkinek. Hexán, például, nem változtatja meg a fellépés tömény kénsavat, füstölgő salétromsav, megolvasztott nátrium-hidroxid, kálium-permanganát vagy krómsav. Kivételével nátrium-hidroxid, ezeket a reagenseket reagáltatunk alkének, még szobahőmérsékleten is. Azoknak néhány a reakciók, amelyek képesek alkánok, meg kell alkalmazni szigorú körülmények között, mint például a magas hőmérséklet, vagy specifikus katalizátorok.
jelenleg
90% alkánok előállított petróleum égett üzemanyagként belső égésű motorok és erőművek. Ez elfogadhatatlan mint alkánok erősen hajlamosak a gyökös reakciók, és szolgálhat értékes nyersanyagként in Organic Synthesis. Egy példa egy gyökös reakció egy halogénezési reakciót. Tekintsük a példa a legegyszerűbb klórozás Képviselő alkánok - metán.
Metán klórozásával egy fontos ipari eljárás. Szekvenciális szubsztitúciós hidrogénatomok klóratomok a molekulában vezet a termelés a metil-klorid CH3 Cl, CH 2Cl 2 diklór-metán. triklór-metán (kloroform) és szén-tetraklorid CHCI3 (szén-tetraklorid) CCI4. Mind a négy termék egy jelentős alkalmazás szerves szintézis, különösen a (kivéve a klór-metán), mint oldószert.
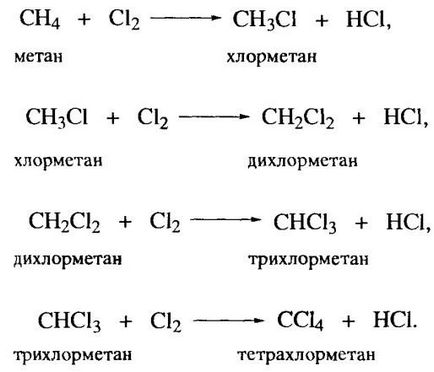
A termikus klórozást általában végbemegy a gáz fázisban, a hasítása a klór molekula elért megfelelően magas hőmérsékleten (250-450 ° C). Fotokémiai klóro végezhetjük szobahőmérsékleten; míg a leghatékonyabb fény fény egy 340 nm hullámhosszon megfelelő maximális abszorpciós klórt. Alkalmazásakor egy gyökös reakció iniciátorok klórozást úgy hajtjuk végre mérsékelt hőmérsékleten (80-100 ° C).
A metán klórozásával megy végbe, mint egy gyökös folyamat, mert atomi klórt vesz részt a fejlesztési szakaszban áramkör, ismét kialakult a következő lépésben. Limbo áramkör (iniciációs). amely a kialakulását a szabad klór atomok által május több módszer: termikusan, fotokémiailag és használata iniciátorok.
Ebben leírnak reakció mechanizmusa előforduló szekvencia elemi változások során reagáló molekulák. Ez boncolt részletesen a mód, ahogyan a reakció. Meg kell magyarázni az alapítási reakció termékek és konfigurációjú.
Az alábbiakban, példaként, képviseli metán klórozási reakció mechanizmusát.

A reakcióhő által meghatározott? H 0 2. lépés és a 3. (lánc növekedés), és nem tartalmazza hatásait a nukleációs és láncterminációs lépéseket.
Így, metán klórozásával exoterm reakció és folytatja a felszabadulás jelentős mennyiségű hőt.
Skorostlimitiruyuschey szakaszban, azaz a lépésben meghatározzuk a sebesség egy kémiai reakció a klórozási lépésben 2 metán; ez megfelel az átmeneti állapot PS1. Szerves átmeneti állapotának a reakció lehet tanulmányozni szokásos fizikai-kémiai módszerekkel, az általános esetben meg kell szimulálni vagy a kiindulási reagensekben vagy az intermedier vegyületek vagy végtermékek. A legjobb modell PS részecskék jönnek, hogy ez az energia átmeneti állapot. Ez a rendelkezés az úgynevezett Hammond posztulátum.
Formálisan szabad metilcsoport van egy tetraéderes szerkezetű.
Azonban, mivel a kis nagyságrendű inverziós az akadály (az átmenet formájában egy molekula egy másik) statisztikailag legvalószínűbb planáris szerkezete a metán molekula, azaz a Minden 4 atomok fekszenek ugyanabban a síkban.
Milyen további érvek mellett a radikális ismert mechanizmus metán klórozás, kivéve, hogy ez a reakció megindításához UV sugárzás? Meg kell jegyezni, legalább két tény, megerősítve a bevonása gyökök a reakcióban.
- A reakciót lassította oxigén hozzáadása a reakcióelegyhez, mivel ez az aktív alkil-gyökök alakítjuk inaktív alkilperoxid gyökök RO2.
Oxigén, kedveznek egy inhibitora gyökös reakciók (kémiai reakció lelassul).
- Ezzel szemben, a iniciátorok gyökös reakciók felgyorsítása a metán klórozásával. Ez az ingatlan, különösen tetraetil ólom, a képződése könnyen lebontható etilcsoport.
Etilcsoport áll, amely esetben egy gyökös reakció iniciátor.
A klórozás homológok szabadgyökök metana.Ustoychivost
Ami a metán homológok és azok gyökök stabilitása növekszik a sorozatban metil-, etil-, izopropil- és terc-butil-csoport:
miatt delokalizációja a párosítatlan elektront (spin sűrűség) részvételével a metilcsoportok kötődik a gyök középpontját.
Különböző ellenállás közben keletkező gyökök alkil meghatározza a relatív aktivitása a harmadlagos, szekunder és primer CH kötést alkánok. Például, a relatív aktivitása a szekunder és primer C-H kötések egyenlő 4: 1. Ez azt eredményezi, hogy a reakció előnyösen megy végbe a kialakulását 2-klór-propán (kitermelés = 57%)
Klórozási reakciót propán 25 ° C-flow, így regioszeiektív. Regioszelektív reakció - ez egy olyan reakció, amelynek során átmegy kémiai változásokon túlnyomórészt egy vagy két vagy több, a rendelkezéseinek a reagens molekula.
Regioszelektív reakciók rendkívül gyakori a szerves kémiában. Nézzük tehát, még a saját meghatározás. Először is, az értékelés során figyelembe kell venni a régiószelektivitása statisztikai tényező. Ezen túlmenően, míg a reakció központok kell azonos kémiai természetét. A reakciókat az úgynevezett teljes mértékben (100%) regioszelektív ha a változás van kitéve csak egy pozícióban. Reakció úgynevezett részleges (X%) regioszelektív ha a változás egyik helyzetben elsőbbséget élvez egyéb rendelkezések. A különbség lehet végezni, fél-kvantitatív szinten, és megkülönböztetni a magas és az alacsony régiószelektivitása. Korábban javasolt kifejezés „regiospecifitásuk” a 100% regioszelektivitását. Jelenleg ez nem ajánlott, mert a konfliktus a „sztereoszelektív” és „sztereospecificitás”.
Fontos hangsúlyozni, hogy a relatív aktivitását a C-H kötést alkánok, többek között, amikor a klórozó, hogy nagymértékben függ a hőmérséklettől. Különösen, klórozása propán 450 ° C-on ad a következő izomerek eloszlása:
Ebben az esetben, a tevékenység a primer és szekunder C-H kötést egyaránt 1: 1.
Addíciós reakció klórral, alkánok reagálhatnak más halogének, mint egy gyökös mechanizmussal, ahol a készítmény a reakció termékek határozza meg nem csak a viszonylagos stabilitás közbensőleg képező alkilcsoportok, hanem a tevékenység a halogénatom, a támadó alkán molekula.
Nitrálásávaí alkánok először töltött MI Konovalov fellépés -edik 10-20% -os salétromsavhoz 120-150 ° C (reakció Konovalov 1888 YG). Jelenleg több tervezet ismert ipari nitrálásával alkánok: a folyékony fázisban 100-150 ° C, és a gázfázisban 350-500 ° C-on salétromsav koncentrációja között változik 40-70%.
A mechanizmus ebben a reakcióban - szabad gyök:
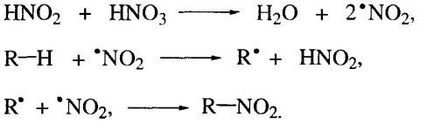
Egy még tömény salétromsavat (60-70%) • NO2 csoport forrás lehet salétromsav és a bomlás a molekula HNO3.
Nitrált alkánok folyékony vagy gázfázisban a nitrogén-dioxid-dimer N2 O4.
Ellentétben a szabad gyökös halogénezési nem nitrálás bevételt láncon keresztül mechanizmus: a szakaszában kialakulásának a nitrovegyület nem folytatódik bármely közbenső szabad gyökök (nem jelenik meg újra a következő lépésben). Azonban, mint abban az esetben, más szabad gyökös reakciók a alkánok, a termékek összetételét nitrálás szintén meghatároztuk képes a különböző C-H kötést a homolitikus szakadás. Azonban, ellentétben a halogénezési reakciók során a nitrálási reakciók gyakran megfigyelhető különbség, és a C-C kötések (destruktív nitrálás).
3. szulfoklórozással alkánok
Szulfoklórozással alkánok alatt UV-besugárzás, szobahőmérsékleten, végbemegy, mint egy gyökös folyamat (Reed reakció, 1936 YG). Mivel az így kapott terméket alkánszulfonsav-kloridok.
A következő a mechanizmus e reakció:
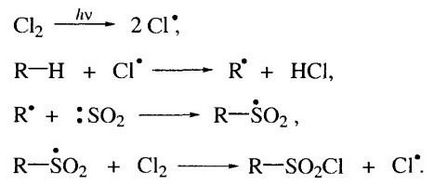
A jellemzője a reakció az a tény, hogy a jelenlétében szénhidrogén egy molekulában a primer, szekunder és tercier szénatomok nem mennek keresztül a csere a hidrogénatomok a tercier szénatommal.
Úgy véljük, hogy ennek az oka a különös reakciót sztérikusan gátolt terjedelmes reagenssel megközelítés tercier szénatommal.
Oxidációja alkánok és bevétel egy gyökös mechanizmussal teljes legyen (amelyekben szén-dioxid és víz):
vagy részleges (a CO és az elemi szén):
Keverékek termelt metán részleges oxidálásával, figyelembe kell venni a legígéretesebb nyersanyag előállítására szintetikus alkánok ipari méretekben.
Egy példa a teljes oxidációja alkánok való felhasználás üzemanyagként hőerőművek és használata benzin frakciók belső égésű motorokban. Az utóbbi esetben, elágazó alkánok, mint a lineáris alkánok a motorok felrobban (robban)!
Tulajdonságok benzin Jellemezze oktánt (O.Ch.). Ebben az esetben azt feltételezzük, hogy a 2,2,4-trimetil-pentán (izooktán), az egyik oktán izomernek oktánszámú egyenlő 100, és n-heptán - oktánszámait nulla. A oktánszám a benzin egyenlő bármilyen tartalom (tf.%) Keverékében trimetil „trimetil - n-heptán,”, amely ugyanazon a detonációs tulajdonságokat a teszt benzin.
A részleges oxidációjával alkánok
Ezt alkalmazzák a szűkebb körű, hogy készítsen néhány oxigenátokra. A szabályozott oxidációját levegő forráspontú ásványi olajok és paraffin kinyerjük a keletkezett olaj- keveréke magasabb karbonsavak előállítására alkalmas detergensek.
Szulfoxidálással alkánok UV besugárzással is előfordul szabad gyökös folyamat:
Meg kell jegyezni, különös jelentőséget szulfoklórozással és szulfoxidálással reakciók a termelés aikánszuifonsavak számos különböző felhasználási, beleértve a tisztítószereket. „Tisztítás” tulajdonságok alkánszulfonsavak alapuló felületi aktivitása a molekulák ezen vegyületek. Miután két fragmens összetételét - hidrofób (alkánrészben) és hidrofil (szulfocsoport), alkánszulfonsavak molekulák megszerezzék a képesség, hogy tájolja a határfelületen, ezáltal biztosítva a átadását szennyező anyagok egy vizes fázist és azok eltávolítását a szennyezett anyagot.
Termolízis is alkánok gyökös jellegű, de végbemegy a kialakulását a különböző termékek a körülményektől függően.
Termikus reakciójával alkánok is repedés és reformáló. Az úgynevezett kémiai folyamatok használják az iparban a nyersolaj finomítása. Céljuk, hogy növelje a hozam és a minőség a benzin frakciók alkalmas üzemanyagként.
Kitéve a repedés magas forráspontú ásványolaj-maradékokat kapunk a petróleum desztillálása során. Során a repedés a nagyobb molekulatömegű alkánok alakítjuk kis molekulatömegű. Ezt úgy lehet elérni, különösen a használata nagyon magas hőmérséklet - akár 700-900 ° C (termikus krakkolás).
A hátránya a termikus krakkolás, hogy a termékek nem tartalmaznak jelentős mennyiségű elágazó alkánok, miáltal használata nem tud szerezni motor-üzemanyagot magasabb oktánszámú 65-70. A legjobb eredményeket elért rendszerekről katalitikus krakkolás. Ez hajtjuk végre a használata, amely alumínium-szilikát katalizátorra (Y típusú zeolit), és kevésbé alacsony hőmérsékleten (400-450 ° C).
Még hatékonyabb eljárás előállítására üzemanyag maximális oktánszámú megreformálása. Ez a folyamat alakítja az átlagos lineáris alkánok és cikloalkánok aromásokká tovább.
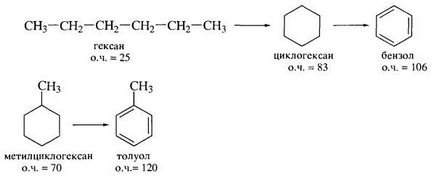
Ellentétben katalitikus krakkolás, amely végzik savas típusú katalizátorok a reformálási eljárásban heterogén katalizátorokat alkalmaznak dehidratáló. Ha használt a reformálási eljárásban platinorenievye katalizátorok, ezt a folyamatot nevezik platform.
Katalitikus módszerek visszavezetésére ásványolaj frakciók hátterében szénhidrogén alapanyag termelés ipari szerves szintézisekben.
Hajlandóság alkán gyökös reakciók csak jelentősen korlátozza a közvetlen adagolásának molekulák a különböző funkcionális csoportok. Ezért vegyészek irányuló erőfeszítéseket, hogy új reakciói alkánok. Így például az ionos reakciók már kinyitott.
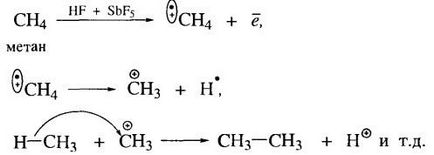
Átlagos alkánokból kisebb ionizációs potenciál, kialakítására képesek karbokationok alávetni izomerizáció és oligomerizációs hatása alatt erős Lewis-savak.
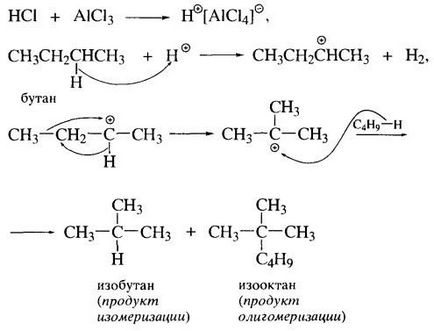
A hajtóerő az átrendeződés a másodlagos szénkation Felsőfokú a különbség a stabilitási: Felsőfokú a legjobb feltételeket a delokalizációjával a pozitív töltés.