fél-reakció módszerrel algoritmus
Sok kémiai folyamatok végzik változást oxidációs foka az atomok, amelyek alkotják a reaktív vegyület. Írásban egyenletek reakciók redox típusú gyakran kíséri nehézség együtthatóinak előtt minden formula anyagokat. Erre a célra módszereket fejlesztettek az elektronikus vagy elektronikus ionos töltés eloszlása egyensúlyt. A cikk bemutatja a második utat felfelé az egyenleteket.
fél-reakció módszerrel, a lényege
Kéri továbbá, elektron-ion egyensúly megoszlási együttható szorzók. Alapján módon történő cseréjének negatívan töltött részecskéket közötti anionok vagy kationok oldódási közegben, különböző pH-érték.

A reakciókat az oxidatív és reduktív elektrolitok típusa részt negatív ionok vagy pozitív töltést. Egyenletek molekulaion fajok, alapuló fele reakció módszerrel van szó, világosan bizonyítják a lényege bármely folyamat.
Hogy létrehozzák a egyensúlyt az elektrolitok segítségével egy speciális jel erős kapcsolat, mint az ionos részecskék és laza kapcsolat, és a gáz betétek formájában disszociálatlan molekulák. A készítmény jeleznie kell áramkörök részecskék, amelyek változtatni oxidáció mértéke. Annak megállapításához, a kioldó közeg egyensúly jelölik savas (H +), alkáli (OH -) és semleges (H2 O) körülmények között.
Mert mi haszna?
A WRA eljárás arra irányul, hogy fél-reakció egyenletek írásban ionos külön oxidációs és redukciós folyamatokat. A végső egyenleg lesz az összeg.
végrehajtási szakaszt
Írás saját sajátosságai fél-módszerrel. Az algoritmus a következő lépéseket tartalmazza:
- Az első lépés az, hogy írjuk le képleteket minden reagens. Például:
- Ezután állítsa be a funkciót, a kémiai szempontból, a folyamat az egyes összetevők. Ebben a reakcióban KMnO4 jár oxidálószer, H2 S egy redukálószer és HCI meghatározza savas környezetet.
- A harmadik lépés kell írni egy új sorban képletű ionos vegyületek reagáltatásával egy erős elektrolittal potenciál az atomok közül van egy változás oxidációs fokú. Ebben a reakcióban MnO4 - működik, mint egy oxidálószer, H2 S a redukáló szer és H +, vagy egy oxónium kation H3 O + határozza savas környezetet. A gáz-halmazállapotú, szilárd vagy gyenge elektrolitikus vegyület kifejezett intakt molekuláris képlete.
Ismerve a kiindulási komponensek, hogy megpróbálja meghatározni, hogy milyen oxidáló és redukáló szer kerül redukált és oxidált formája, ill. Néha végső anyagok már meghatározott feltételek, ami megkönnyíti a munkát. Az alábbi egyenletek azt mutatják, átmeneti H2S (hidrogén-szulfid), hogy S (kén), és anion MnO4 - a Mn 2+ kation.
A mérleg a atomi részecskék a bal és a jobb oldali rész a savas környezetben adunk hidrogén-kation H + vagy egy molekula víz. A lúgos oldatot adunk hozzá, hidroxidion OH - vagy H2 O.
Egy oldatot, amely oxigén- együtt manganatnyh ionok H + formában vízmolekulák. Ahhoz, hogy kiegyenlítse az elemek száma van írva, mint az egyenlet: 8H + + MnO4 - → 4H2O + Mn 2+.
Ezután kiegyensúlyozó hajtjuk áram. Ehhez, úgy a teljes összeg a töltés is maradt a területen, kiderül hét, majd a jobb oldalon, két kijárat. Az egyensúly a folyamat adjuk a kiindulási anyagok az öt negatív részecskék: 8H + + MnO4 - + 5e - → 4H2O + Mn 2+. Kiderült, félig reakció vissza.
Most egyenlővé az atomok számát, hogy oxidációs folyamatot. Ehhez hozzáadjuk a jobb oldalon hidrogén kationok: H2 S → 2H + + S.
Miután töltés kiegyenlítési végezzük: H2 S -2E - → 2H + + S. Úgy látszik, hogy a kiindulási vegyületek fogyasztó két negatív részecskék. Kiderült fele reakciót az oxidációs folyamat.

Jegyezzük fel a két egyenlet egy oszlopban és sorban a leadott és elfogadott díjakat. A szabály szerint a meghatározása a legkisebb többszörös kiválasztva mindegyik fél reakció a szorzó. Ez szorozva oxidatív és reduktív egyenletet.
Most lehet, hogy végezzen az összegzése a két lap, hajtogatott bal és jobb oldalon együtt, és számának csökkentése elektronikus faj.
8H + + MnO4 - + 5e - → 4H2O + Mn 2+ | 2
H2 S -2E - → 2H + + S | 5
16H + + 2MnO4 - + 5H2 S → 8H2 O + 2Mn 2+ + 10H + + 5S
Az így kapott egyenlet számának csökkentése H + 10: 6H + + 2MnO4 - + 5H2 S → 8H2 O + 2Mn 2+ + 5S.
Mi ellenőrizze a helyességét a ionegyensúly számlálásával oxigénatomok számának a nyilak és után, ami megegyezik a 8. Az is szükséges, hogy ellenőrizze a végső díjak, és a kezdeti, az egyensúly része: (+6) + (-2) = +4. Ha minden egyezik, meg van írva rendesen.
fél-reakció módszerrel zárul az átmenet a molekulaion felvétel az egyenlethez. Minden részecske az anion és a kation része a bal egyensúlyt a ellentétes töltésű kiválasztott ion. Azután átvisszük a jobb oldalon, ugyanazt az összeget. Most, az ionok is csatlakoztatható a teljes molekula.
6Cl - + 2K + → 6Cl - + 2K +
Módszert alkalmazza félig reakciók, az algoritmus, amely írni a molekuláris egyenlet tud együtt az írás jellege elektronikus mérlegek.
Meghatározása oxidálószerek
Egy ilyen szerepe van ionos, atomi vagy molekuláris entitások kap negatív töltésű elektronok. Oxidáló anyagok mennek helyreállítása a reakciókban. Ezek az elektronikus hiányosság, amely könnyen feltölthető. Az ilyen eljárások közé tartozik redox fele reakciót.

Nem minden anyag képes csatolni elektronokat. Erős oxidálószerek közé:
- halogénatom képviselői;
- sav, például salétromsav, kénsav és a szelén;
- kálium-permanganát, dikromát, manganatny, kromát;
- tetravalens mangán és ólom-oxid;
- ezüst és arany ion;
- vegyületet gáz alakú oxigén;
- kétértékű réz-oxidok és egyértékű ezüst;
- klórtartalmú só komponenseket;
- vodka királyi;
- hidrogén-peroxid.
Meghatározása redukáló
Ez a szerep tartozik ionos, atomi vagy molekuláris részecskék, amelyek segítségével egy negatív töltést. A reakciók redukáló anyagok oxidatív hatást hasításával elektronok.
- Képviselői számos fém;
- tetravalens kénvegyületek és a hidrogén-szulfid;
- halogén savak;
- vas, króm, és a mangán-szulfát;
- ón-klorid;
- nitrogéntartalmú savak, mint például a dinitrogén-reagensek, ón-oxid, hidrazin és ammónia;
- természetes szén és a kétértékű oxid;
- hidrogén molekula;
- foszforossavat.
Előnyök A módszer az elektron-ion
Írni egy redox reakció, félig reakció módszert alkalmazzák gyakrabban, mint az elektronikus típusú egyensúlyt.
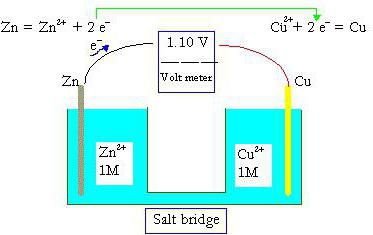
Ez annak köszönhető, hogy az előnyöket az ion-elektronos folyamat:
- Abban az időben az írás az egyenlet figyelembe véve a tényleges ionok és vegyületek, amelyek léteznek a megoldás része.
- Nem lehet kezdetben információnk vegyületét kapott, ezek határozzák meg a végső szakaszában.
- Nem mindig szükséges adatokat az oxidáció mértékét.
- Mivel a módszerrel lehetséges, hogy tudja az elektronok száma vesz részt a fél-reakció, mint a változó a pH-értéke az oldat.
- A redukált egyenleteket ionos vizsgált fajnál jellemző folyamatok és a szerkezet a kapott vegyületeket.
Half-reakciót savas oldatban
Elvégzése a számításokat feleslegben hidrogén ionok engedelmeskedik az alapvető algoritmus. Módszer félig reakciót savas közegben egy rögzítés kezdési része minden folyamat. Ezután ezeket formában kifejezve az egyenletek ionfajta megfelel az egyensúlyt az atomi és az elektromos töltést. Külön rögzített folyamatok oxidatív és reduktív jellegű.
Ahhoz, hogy összehangolja a atomos oxigén mellékreakcióiként fölöslegben hozza hidrogén kationok. A mennyiségű H + elegendőnek kell lennie ahhoz, hogy megkapjuk a molekuláris vizet. Felé az oxigénhiány is jóvá H2 O.
Ezután végezzük az egyensúlyt a hidrogénatomok és elektronok.
Készíts egy összegzése egyenletek előtt és után a nyíl az elrendezése az együtthatók.
Végezze ugyanazt a csökkentést az ionok és molekulák. A már rögzített reagensek összesen hozzáadásával hiányzó egyenlet működnek anionos és kationos faj. Számuk előtt és után a nyíl meg kell egyeznie.
Egyenlet OVR (fél-reakció módszer) tekinthető teljesítettnek, ha az írás egy kész kifejezés a molekuláris faj. Továbbá minden egyes alkatrész kell egy bizonyos tényező.
Példák a savas körülmények között
A reakciót nátrium-nitrit és klórsav, így nátrium-nitrát és sósav. A elrendezése a együtthatók módszerével félig reakciók, példák az írás egyenletek társított jelzést a savas környezet.
ClO3 - + 6H + + 6e - → 3H2 O + Cl - | 1
3Na + + H + → 3Na + + H +
Ebben a folyamatban, egy nitrit nátrium-nitrátot kapunk, és a klórsav képződött sót. Oxidáció mértékét változások nitrogénnel 3-5, és a klór töltés 5 válik -1. Mindkét termék nem képez csapadékot.
Half-reakció lúgos környezetben
Levezetése számítások, amikor a felesleges hidroxid ionok megfelel a számításokat savas oldatok. Módszer fele reakciót lúgos közegben is kezdenek, hogy kifejezze az eljárás komponenseinek formájában ionos egyenletek. Különbségek során megfigyelt igazítását atomos oxigén. Így, eltekintve a reakciót fölöslegben vett molekuláris, hogy a vizet, és az ellenkező oldalon hozzáfűz hidroxid aniont.
Az együtthatót a molekula H2 O jelzi a különbség az oxigén mennyiségét előtt és után a nyíl, és az ionok OH - ez megduplázódik. Alatt oxidálószer meghatalmazotti redukálószerrel O atomok hidroxil-anionok.
Módszer fele reakciót befejezi végző a további lépéseket az algoritmus, amely egybeesik a folyamatokat, amelyek valamely feleslegben alkalmazott sav. A végeredmény az egyenlet a molekulák.
Példák lúgos közegben
Keverésekor jódot nátrium-hidroxid képződött kálium-jodid és jodát, a vízmolekulák. Az egyensúly folyamat segítségével fele reakció módszerrel. Példák a lúgos oldatok megvan a sajátosságok kapcsolatos kiegyenlítését atomos oxigén.
I + e - → I - | 5
6OH - + I - 5e - → I - + 3H2 O + IO3 - | 1
6Na + → Na + + 5Na +
6NaOH + 3I2 → 5NaI + NalO 3 + 3H2 O.

Az eredmény a reakció az eltűnése a lila elszíneződése molekuláris jód. Van változás oxidációs állapotban az elem 0-1 és 5. alkotnak-jodid és nátrium-jodát.
Reakció egy semleges környezetben
Jellemzően arra utal, hogy folyamatok előforduló a hidrolízis alkotnak gyenge sav sói (a pH-érték 6 és 7) vagy enyhén bázikus (pH = 7-8) oldatot.
fele reakció módszerrel semleges közegben kerül rögzítésre több változatban.
Az első módszer nem veszi figyelembe a só hidrolízise. A tápközeget vesszük a semleges és a bal oldalon a nyíl attribútum molekuláris vizet. Ebben a kiviteli alakban, egy félig-reakciók savas, és egy másik - a lúgos.
A második módszer alkalmas eljárásokat, amelyek során lehetőség van arra, hogy létrehozza a közelítő pH-érték. Ezután a reakcióelegyet az eljárás ion-elektron tekinthető lúgos vagy savas oldatban.
Példa semleges közegben
Amikor a hidrogén-szulfid-vegyületet nátrium-dikromát vizet kapunk csapadékot kén, nátrium és a három vegyértékű króm-hidroxidot. Ez egy tipikus válasz egy semleges oldat.
H2 S - 2e - → S + H + | 3
7H2 O + 3H2 S + Cr2 O7 2- → 3H + + 3S + 2CR (OH) 3 + 8OH -. Hidrogén kationok és a hidroxid anionok kombinálva, egy 6 vízmolekulával. Ők lehet távolítani a jobb és a bal, így a felesleget a nyíl.
A reakció végén egy csapadék króm-hidroxid kék és sárga színek kén a lúgos oldatban nátrium-hidroxiddal. A oxidatív ereje az elem S válik -2 0, és a megbízott króm +6 átalakított 3.

Hogyan lehet egyszerűen megszabadulni a hasi zsír? 23 módon körülbelül egyharmada ember van ezen a bolygón felesleges hasi zsír. Ha ezek közé, de nem tudom, hogyan kell megjavítani a legkevésbé.
