A oldhatóságát anyagok vízben
Úgynevezett termodinamikailag stabil oldat homogén (egyfázisú) váltakozó végű álló rendszer két vagy több komponensből (vegyszerek). A komponenseket alkotó megoldást, amelyek az oldószert és oldott anyag. Jellemzően, a komponens kell tekinteni olyan oldószer, amely létezik a tiszta formában az azonos aggregált állapotban, és hogy az így kapott oldatot (például, abban az esetben a vizes oldószer egy sóoldat, természetesen, víz). Ha mindkét komponenseket feloldódni hasonló halmazállapotban (például alkohol és víz), majd az oldószert tartják a komponensek található a nagyobb mennyiségű.
Az oldatok olyan folyékony, szilárd és gáznemű.
A folyékony oldatok - a só oldatok, cukor-alkohol vízben. A folyékony oldatok lehetnek vizes és nem-vizes. A vizes oldatok - olyan oldatok, amelyekben az oldószer víz. A nemvizes oldatok - olyan oldatok, amelyekben az oldószerek szerves folyadékok (benzol, alkohol, éter, stb). A szilárd oldatok - fémötvözetek. Gáznemű megoldások - a levegő és egyéb gázok keverékei.
A folyamat a feloldódást. Kioldódási - egy komplex fizikai-kémiai folyamat. Ha a fizikai folyamat a megsemmisítése a szerkezetét az oldott anyag, a részecskeméret eloszlása közötti oldószer-molekulákat. A kémiai folyamat - a reakció oldószer-molekulákkal az oldott anyag részecskék. Ennek eredményeként ez a kölcsönhatás alakul szolvátjai. Ha az oldószer víz, a képződött szolvát nevezzük hidrátok. A folyamat kialakulásának a szolvátok nevezzük szolvatáció, A hidrátok képződésének - hidratációs. Bepárlásával a vizes oldat képződött kristályos hidrátokat - kristályos anyagok, amelyek magukban foglalják egy bizonyos számú vízmolekulák (kristályvizet). Példák a kristályos: CuSO 4. 5H2 O - réz-szulfát (II); FeSO4. 7H2 O - heptahidrát vas-szulfát (II).
A fizikai folyamat oldódási megy az energia elnyelését, a kémiai - a kiadás. Ha eredményeként hidratációs (szolvatáció) több energiát termel, mint felszívódik a megsemmisítése a anyag szerkezetének, az oldódási - exoterm folyamat. A energia felszabadulása játszódik feloldásával NaOH, H2 SO4. Na 2CO 3. ZnSO4 és egyéb anyagok. Ha a megsemmisítés a szerkezet az anyag több energiát igényel, mint amennyit során felszabaduló hidratálás feloszlatása - endoterm folyamat. Felszívódás energia akkor jelentkezik, ha a vízben oldott NaNO 3. KCI, NH4 NO3. K2 SO4. NH4CI és bizonyos más anyagok.
Az energia mennyisége, amely megjelent vagy abszorbálhatjuk oldódás, az úgynevezett termikus hatása oldódását.
Az oldott anyagok úgynevezett a képessége, hogy kell elosztani egy másik anyagban formájában atomok, ionok vagy molekulák a termodinamikailag stabil elegy a rendszer változó. A mennyiségi jelleggörbe oldhatóságának együtthatója oldhatóság. amely jelzi, hogy milyen maximális anyag tömege lehet feloldunk 1000 vagy 100 g vízben egy adott hőmérsékleten. A oldhatósága anyag természetétől függ az oldószer és az anyag a hőmérséklet és a nyomás (gázoknál). Oldhatóság szilárd anyagok általában növekszik a hőmérséklet emelkedésével. A oldhatósága gázok növekvő hőmérséklettel csökken, de a növekvő nyomás esetén növekszik.
A vízben oldható anyagokat három csoportra oszthatók:
2. takarékosan (m.). Oldhatóság szerek 0,01 g-10 g közötti 1000 g vizet. Például, 2 g (CaSO4. 2 H2 O) feloldunk 1000 g vízben.
3. Gyakorlatilag nem oldódik (n.). Az oldhatóság az anyagok kevesebb, mint 0,01 g 1000 g vízzel. Például, 1000 g vízben feloldunk 1,5. 10 -3 g AgCl.
Amikor oldott anyagok képezhet, telített, telítetlen és túltelített oldatokat.
Telített oldatot - olyan oldat, amely a maximális mennyiségű oldott anyag az adott körülmények között. Azáltal, ilyen anyag az oldatban már nem oldható anyag.
Telítetlen megoldás - olyan megoldás, amely tartalmazza az oldott anyag kevesebb, mint telített a megadott körülmények között. Azáltal, ilyen anyag oldott anyag feloldódása.
Néha lehetséges, hogy olyan oldatot kapjunk, amelyben egy oldott anyag tartalmazza több, mint egy telített oldat egy adott hőmérsékleten. Egy ilyen megoldás az úgynevezett túltelített. Ezt az oldatot úgy állítjuk elő, lassú hűtésével telített oldatot szobahőmérsékletre. Túltelített oldatok nagyon instabil. Kristályosítás anyagot egy ilyen megoldás is okozhat dörzsölés egy üvegbottal által az edény faláról, amelyben az aktív oldatot. Ezt a módszert alkalmazzák amikor bizonyos minőségi reakciókat.
A az anyag oldhatóságát lehet kifejezni, és annak moláris koncentrációja telített oldat (2.2).
oldhatósága állandó. Úgy véljük, a lezajló folyamatok a kölcsönhatás egy gyengén, de erős elektrolit BaSO4 bárium-szulfát vízzel. Az intézkedés alapján a víz dipólusok és ionok Ba 2+ SO4 2 - BaSO4 a kristályrács fog mozogni a folyékony fázisba. Ezzel egyidejűleg a folyamat, hatása alatt az elektrosztatikus mező a kristályrács részét Ba 2+ iont és SO4 2 - újra lesz letétbe (3.ábra). Ezen a hőmérsékleten egy heterogén rendszerben, végül a egyensúly jön létre: a kioldódási sebesség a folyamat (V1) egyenlő a felviteli folyamat sebesség (V2), azaz
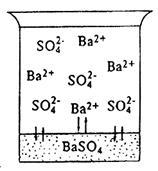
Ábra. 3. A telített bárium-szulfát-oldatot
Az oldatot, amely egyensúlyban van a szilárd fázisú BaSO4. Ez az úgynevezett telített tekintetében bárium-szulfát.
A telített oldatot egy egyensúlyi heterogén rendszert, amelyet az jellemez, a kémiai egyensúlyi állandó:
ahol egy (Ba 2+) - Aktivitás báriumion; egy (SO4 2-) - Aktivitás szulfátionok;
a (BaSO4) - Aktivitás molekulák báriumszulfát.
A nevező Ennek a frakciónak - aktivitású kristályos BaSO4 - egy állandó egyenlő egységét. A termék a két állandók ad egy új állandó érték, amely az úgynevezett termodinamikai és oldhatósága állandó Ks jelölésére °:
Ezt az értéket használjuk, hogy az úgynevezett oldhatósági terméket, és egy egyenes.
Így, mérsékelten oldódik telített oldatban egy erős elektrolit terméket egyensúlyi aktivitása annak ionok állandó egy adott hőmérsékleten.
Feltételezve, hogy egy gyengén oldódó elektrolit telített oldat aktivitási együttható f
1, a tevékenység ionok ebben az esetben helyettesíthető azok koncentrációját, valamint a (X) = f (x). C (X). A termodinamikai oldhatósági konstans Ks ° belép a koncentrációja oldhatósági konstans Ks:
ahol C (Ba 2+) és C (2 SO4 -) - egyensúlyi koncentrációja Ba 2+ iont és SO4 2 - (mol / l), telített vizes bárium-szulfát.
Az egyszerűség kedvéért a számítások általában a koncentráció oldhatósága állandó Ks. Figyelembe f (X) = 1 (2. függelék).
Ha az erős elektrolit képez egy gyengén oldódó upon disszociációs egyes ionok expressziós Ks (Ks vagy °) megfelelő mértékben megegyezik a sztöchiometriai arányok:
Általánosságban, a kifejezés egy konstans koncentrációjú elektrolit oldhatósági Am Bn # 8644; m A n + + n B m - a formája
ahol a C - koncentrációja ionok A n + és B m - egy telített elektrolit oldat mol / l.
Érték Ks hozott, hogy csak tekintetében elektrolitok, amelynek oldhatósága vízben nem haladja meg a 0,01 mól / liter.
Feltételei, csapadékképződés
Tegyük fel, a - a tényleges ionkoncentráció nehezen oldódik az elektrolit oldatban.
Ha C m (A n +). C N (B m -)> Ks. akkor csapódik ki, mivel az oldat túltelítetté válik.
Ha C m (A n +). C N (B m -)
A tulajdonságait a megoldásokat. Az alábbiakban figyelembe vesszük a tulajdonságokat oldatok nemelektrolitok. Abban az esetben, elektrolitok a fenti képletben adjuk izotóniás korrekciós együttható.
Ha feloldjuk egy folyékony, nem-illékony anyag, a gőznyomás az oldat felett kisebb, mint a gőz nyomása alatt tiszta oldószert. Egyidejűleg csökkenti a gőznyomás alatt az oldatot megfigyelt változás a forráspontja és fagyasztás; oldatok forráspont hőmérséklet-emelkedés, és a fagyasztás hőmérséklet csökken képest hőmérséklet jellemző a tiszta oldószerekben.
A relatív csökkentése A fagyáspont vagy relatív növekedése a forráspontja közötti hőmérsékleten az oldat koncentrációjával arányos:
ahol K - konstans (oszmométerek vagy ebulioskopicheskaya);
CM - molal koncentrációja az oldat mol / 1000 g oldószer.
Mivel Cm = m / M, ahol m - anyag tömege (g) 1000 g oldószer
M - moláris tömeg, a fenti egyenlet felírható:
; .
Így, ismerve a értéket minden oldószert megadásával m és kísérletileg meghatározzuk # 8710; t a készülékben M oldott anyag.
Móltömeg az oldott anyag lehet meghatározni, hogy mérjük az ozmotikus nyomás az oldat (π), és úgy számítjuk ki, az alábbi egyenlet Van't - Hoff:
; .